Présentation de l'équipe
Le métabolisme cellulaire est basé sur des transferts d’électrons qui s’accompagnent de transports de protons. Notre recherche vise à améliorer les connaissances scientifiques sur les mécanismes et les implications pathophysiologiques de la régulation de l’homéostasie redox et du pH des cellules et des 
Publications cf bas de page
Mots clés
Homéostasie tissulaire
Homéostasie cellulaire
Echangeurs
pH
Pancréas
Rein
Coeur
Transplantation
Métabolisme
Stress oxydatif
Régénération
Responsables
Thèmes de recherche
- Transports et métabolisme
-
Notre équipe se concentre sur l’étude de l'homéostasie cellulaire et tissulaire, avec des projets répartis en plusieurs axes depuis l'étude des mécanismes moléculaires jusqu’aux implications pathologiques.
- AXE 1. Régulation du pH intracellulaire par les échangeurs Na+/H+ (NHE) dans la réponse cellulaire au stress et à l’environnement: Implications en conditions physiologiques et physiopathologiques.
Responsables : Laurent Counillon et Mallorie Poët. -
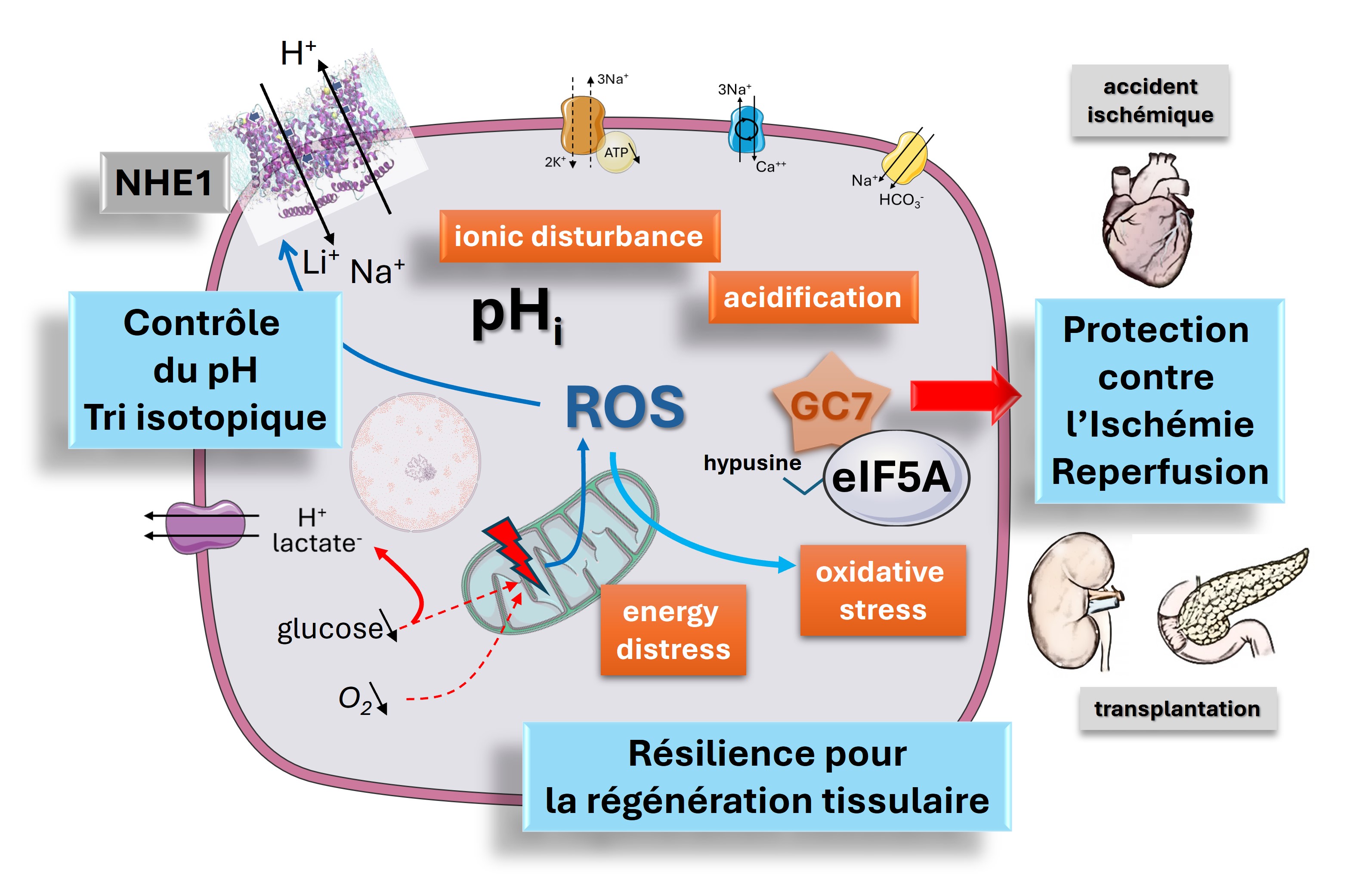
Les échangeurs de la famille NHE sont indispensables au contrôle du pH cellulaire, du volume, de la prolifération, de l'équilibre salin de l'organisme et vont être régulés de manière fine selon les conditions. Leur fonctionnement est couplé à l’ensemble des mécanismes de transport ionique, et une partie de notre travail consiste en l’établissement d’un modèle mathématique du transport ionique et de la régulation du pH intracellulaire. L’altération fonctionnelle de ces transporteurs va ainsi être impliquée dans de nombreuses pathologies comme les troubles neurodéveloppementaux ou encore l’infarctus du myocarde. L’équipe s’intéresse ainsi à leur régulation par les espèces réactives de l'oxygène et de l'azote retrouvé par exemple lors d’une ischémie, mais aussi à leur rôle dans les interactions plantes/pathogènes ou dans le fractionnement isotopique du lithium. En effet, ce cation (Li) qui a un large éventail d'utilisations en médecine et dans l’industrie, existe sous deux formes isotopiques stables, le 6Li et le 7Li. En couplant des mesures de transport ionique à des analyses isotopiques, nous avons montré que NHE1, entre autres, était capable de fractionner ces isotopes qui n’ont qu’un neutron de différence. Cette découverte a une importance fondamentale en biochimie et apporte une réponse à la question qui se posait en géochimie sur la possible contribution biologique aux fractionnements isotopiques mesurés pour la reconstruction des paléoclimats.
Principaux projets en cours
*Caractériser le dialogue précoce entre les plantes hôtes et les OOmycètes pathogènes: approches biologiques et physiques. ANR COOL (2023-2025). Coordinateur: Eric Galiana (INRAE, Valbonne).
*Membrane Transport of Stable Isotopes. Partenaire du projet SeaLi2Bio “Biological Isotopy of Lithium in Littoral Zones” dirigé par Nathalie VIGIER (LOV, Villefranche s/mer) ERC Advanced Grant (2023-2027) .
*Modélisation Mathématique du transport et de la régulation du pH intracellulaire. MITI-CNRS (2024-2027). Collaborateurs Yann BOURET, Médéric ARGENTINA (INPHYNI, Nice). - AXE 2. Processus cellulaires et moléculaires impliqués dans la régénération de l’épithélium rénal de l’adulte.
Responsable : Marina Shkreli. -
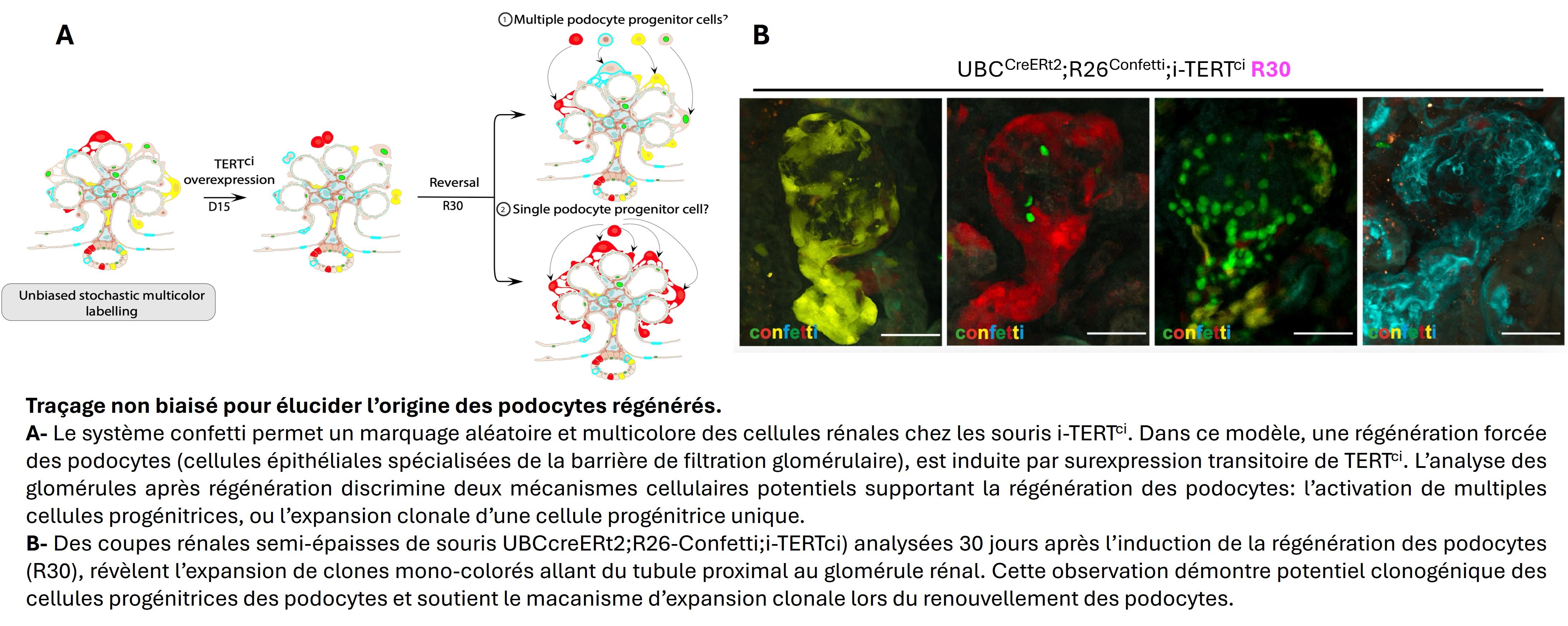
L’identité des cellules progénitrices rénales reste débattue, et les mécanismes moléculaires impliqués dans la régulation de ces cellules sont peu compris. Nous avons identifié une population de cellules progénitrices dans le rein adulte, exprimant des marqueurs spécifiques et capable de régénérer plusieurs types cellulaires du néphron. Nos travaux visent à caractériser l’implication de ces cellules la régénération rénale, et à déterminer les signaux qui contrôlent leur mobilisation et leur différenciation. Nous étudions également leurs propriétés métaboliques uniques qui leur confèrent leur résilience face au stress oxydatif. En caractérisant leur altération en conditions pathologiques et lors du vieillissement, notre objectif à long terme est de développer des stratégies thérapeutiques innovantes visant à moduler l’activité de ces cellules pour favoriser la régénération rénale lorsque l’organe est défaillant.
Principaux projets en cours
*Definition of relevant therapeutic strategies for elderly patients with renal cancer. ARC_Cancer&Aging TELOMEREIN (2023-2027). Coordinateur Gilles PAGES (IRCAN). Collaborateurs Delphine BORCHIELLINI, Emmanuel CHAMOREY and Damien AMBROSETTI (CHU Nice).
*Specific targeting of drivers of fibrotic disorders of the kidney and the lung. ANR FibrotargLungKidney (2023-2027). Coordinateur Gilles PAGES (IRCAN). Collaborateurs Arnaud JACQUEL (C3M), Julien CHERFILS (IRCAN), Roca Therapeutics, Kekkan Biologics.
*Air pollution as a causal factor in immune dysregulation behind membranous nephropathy. ANR AIRGEM (2025-2028). Coordinatrice Barbara SEITZ-POLSKI (IRCAN, CHU Nice). Collaborateurs Antoine SICARD (LP2M), Andreas SCHEDL (iBV), Laetitia SEGUIN (IRCAN). - AXE 3. Mécanismes de l'ischémie/reperfusion et stratégies de protection.
Responsable : Didier Pisani. -
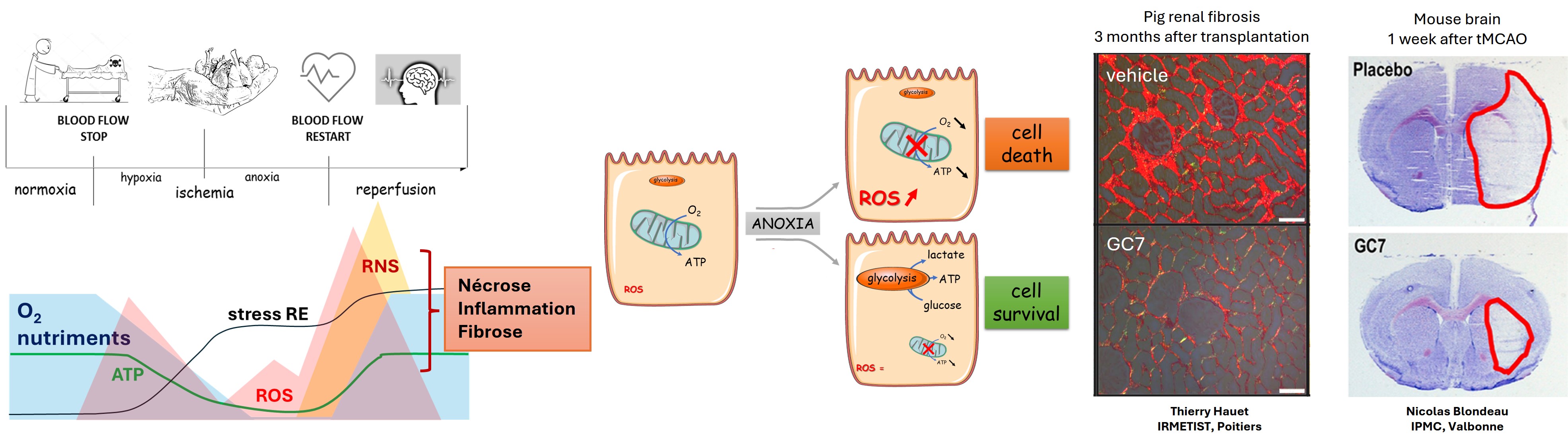
Le stress oxydatif est l'un des stress les plus délétères auxquels un organisme de mammifère doit faire face. Dans des conditions physiologiques normales, les espèces réactives de l’oxygène et de l’azote (ROS & RNS) jouent un rôle fondamental dans la signalisation cellulaire. Les ROS sont produites principalement par les chaines respiratoires des mitochondries et par des complexes enzymatiques situés dans le cytosol et au niveau de la membrane plasmique, alors que les RNS sont issues essentiellement de l'oxyde nitrique (NO) produit par les NOS. Dans certaines situations pathologiques ou lors d'un arrêt transitoire de la ciculation sanguine, on parle alors d'ischémie/reperfusion, les systèmes anti-oxydants endogènes sont surchargés et les espèces réactives vont interagir indistinctement avec les lipides (peroxydation) ou les protéines (nitrosylation, nitrotyrosination, carbonylation et oxydation) conduisant à des altérations de l'homéostasie cellulaire et finalement à la mort des cellules.
Nous développons des stratégies de lutte contre le stress oxydatif en diminuant son apparition grâce à l'identification de nouvelles cibles pharmacologiques, dont par exemple la voie de l’hypusination d’eIF5A dont l’inhibition permet d'améliorer la tolérance ischémique en condition de stress. En effet, nous avons montré dans des modèles précliniques de transplantation rénale et d’accident vasculaire cérébral (AVC) l'efficacité du GC7, un inhibiteur de l'hypusination d'eIF5A, dans la protection des organes contre l'ischémie/reperfusion (IR) quand il est utilisé en pré- mais aussi en post-traitement de l'ischémie. Le GC7 entraîne une augmentation de la survie et une meilleure récupération fonctionnelle des cellules et organes en les protégeant du stress énergétique, du stress du réticulum endoplasmique et bien sûr du stress oxydatif.
Nos projets actuels consistent en l’application de cette stratégie à d’autres accidents ischémiques, comme l’infarctus du myocarde, la transplantation d’ilots pancréatiques ou l'arrêt cardio-respiratoire, mais aussi à une meilleure compréhension des mécanismes permettant cette protection.
Principaux projets en cours
*A therapeutic target for ischemic related injuries: application in organ transplantation. ANR-KIRI (2020-2024). Collaborateurs Thierry HAUET & Luc PELLERIN (IRMETIST, Poitiers), Maria DUCA (ICN, Nice). Descriptif grand public. Lien ANR.
*Inhibition of eIF5A hypusination to protect pancreatic islet and pseudo-islet grafts against ischemia-reperfusion injury. ANR MAXI-ISLETS (2026-2029), SFD (2022-2024) et FRM (2022-2025). Collaborateurs Antoine SICARD (LP2M, Nice) et Eric Renard (CHU Montpellier).
*Impact du GC7 (N1-guanyl-1,7 diamineoheptane) sur le stress oxydatif de patients ayant présenté un arrêt cardio-respiratoire réanimé. AOI CHU (2025-2026). Denis DOYEN.
*A new pharmacological opportunity in acute myocardial infarction by preventing activation of the translation initiation factor eIF5A. ANR MOMI (2024-2027). Collaborateurs Delphine BAETZ (CaRMen, Lyon), Monique BERNARD & Martine DESROIS (CRMBM, Marseille). Lien ANR.
- AXE 1. Régulation du pH intracellulaire par les échangeurs Na+/H+ (NHE) dans la réponse cellulaire au stress et à l’environnement: Implications en conditions physiologiques et physiopathologiques.
- Membres de l'équipe
-
COUNILLON Laurent, PR1 Université Côte d'Azur, Responsable de l'équipe
COUGNON Marc, MCU-HC Université Côte d'Azur
DOYEN Denis, PH CHU Nice
JARRETOU Gisèle, IE CNRS, assistante de prévention
PISANI Didier, CRCN CNRS, Responsable de l'équipeVAN OBBERGHEN Emmanuel, PU-PH Emérite CHU Nice
ALLART Elisa, IE CNRS, ANR
CAILLOT Zakariya, Thèse (cotutelle C3M)
GALLOUIN Jordan, Master 2 UniCA
LE CLEZIO Jeanne, Thèse, MITI (cotutelle INPHYNI)
PAYANT Laurine, AI CNRS (IMEV)
REYNAUD Anaelle, Master 2 UniCA
TANRIKULU Hatice, Thèse, ANR
- Past-members
-
- Ouahmi Hajar (Doctorante 2022-2025) - Nephrologue CHPG Monaco
- Dei Cassilia (Master 2, 2025) - Réanimatrice, CHU Nice
- Bardin Maëva (Master 2, 2025) - Médecin Généraliste, CHU Nice
- Sacher Sukriti (Thèse "Campus Franco-Indien" visiteuse, 2024 - 2025) - Post-Doctorante Stockholm, Suède
- Dos Santos Silva Jose Victor (Post-Doctorant 2024-25) - Post-doctorant
- Bhattacharya Baivabi (Master 2 "Campus Franco-Indien", 2024) - Doctorante Max Planck Institute, Fribourg, Allemagne
- Lavocat Laura (Master 1, 2024) - Doctorante IBV, Nice
- Tauc Michel (DR Inserm 1996 - 2023) - retraite bien méritée
- Samson Elodie (Master 1, 2021) - Ingénieure d'étude, Bordeaux
- Manon Durandy (Master 1, 2020) - Doctorante IRCAN, Nice
- Carcy Romain (Doctorant 202x) - Anesthésiste réanimateur
- Fabris Gaia (Doctorante 2019) - Post-doctorante University of Helsinski, Finland
- Cophignon Auréa (Doctorante 2018) - European Project Manager, Université Côte d'Azur, H2020-MSCA-COFUND: project "BoostUrCareer"
- Melis Nicolas (Doctorant 2015) - Professeur Junior Univeristé de Poitiers, laboratoire IRMETIST.
- Milosavljevic Nina (Doctorante 2012) - Assistant Professor in Neuroscience
- Partenaires
-
FRM - Publications
-
- Tannour-Louet M, Pisani DF, Bouguerra H, Zedda A, Bourcier M, Lamghari N, Gautier N, Chaput B, Riant E, Bouloumié A, Montastier E, Viguerie N, Langin D, Amri EZ, Gourdy P, Tanti JF, Cormont M, Louet JF. NCOA1 is a gatekeeper of the sexually dimorphic thermogenic activity of white adipose tissue. Nat Commun. 2026 Jan 20;17(1):717. doi: 10.1038/s41467-025-65229-6.
- Ouahmi H, Massa F, Cougnon C, Rubera I, Jarretou G, Tauc M, Van Obberghen E, Sicard A* and Pisani DF*. The eIF5A hypusination inhibitor GC7 improves tolerance of pancreatic beta cells to ischemia/reperfusion. American Journal of Physiology-Cell Physiology. 2026 Jan 1;330(1):C56-C69. doi: 10.1152/ajpcell.00631.2025
- Ouahmi H, Massa F, Allart E, Cougnon M, Rouleau M, Van Obberghen E, Shkreli M, Sicard A* and Pisani DF*. Inhibition of eIF5A hypusination improves pancreatic islet transplantation outcomes by promoting ischemia tolerance. bioRvix. 2025 Nov. doi: 10.1101/2025.11.24.689446.
- Tesnière C*, Boudghene-Stambouli F*, Severin M, Poët M, Voisin L, Ponniah M, Pascariu M, Bonneil E, Trempe JF, Thibault P, Counillon L, Pedersen SF and Meloche S. Intracellular pH regulates ubiquitin-mediated degradation of the MAP kinase ERK3. PNAS. 2025 Oct. 122(43) e2501825122. https://doi.org/10.1073/pnas.2501825122
- Lupon E, Perraudin T, Barbat P, Stergiadou S, Njessi P, Dei C, Oyuntogos A, Camuzard O, Pisani DF & Sicard A. An Experimental Human DIEP Flap Model to Investigate Preservation Strategies for Vascularized Composite Allografts and Free Flaps. J Vis Exp. 2025. e69392. doi: 10.3791/69392
- Halper J, Nicolas S, Gilardi F, Winkler C, Materozzi M, Mariano Schiffrin M, Jouzeau J-Y, Blin-Wakkach C, Desvergne B, Chabry J, Pisani DF*, Moulin D*. The adiponectin agonist AdipoRon accelerates osteoporosis development in two different models and modulates adipocyte differentiation. Bone. 2025 Sept. https://doi.org/10.1016/j.bone.2025.117628.
- Njessi P, Barbat P, Piul RS, Pisani DF, Camuzard O, Sicard A, Rodriguez E & Lupon E. Preservation Strategies for Vascularized Composite Allotransplantation: An Updated Systematic Review of a Rapidly Expanding Field. bioRxiv 2025.09.11.675673; doi: https://doi.org/10.1101/2025.09.11.675673
- Cougnon M*, Giraud S*, Materozzi M, Allart E, Rubera I, Mackowiak C, Jarretou G, Boildieu N, Ameteau V, Lemarié E, Ouahmi H, Melis N, Poet M, Duranton C, Pellerin L, Counillon L, Shkreli M, Tauc M, Hauet T and Pisani DF. Inhibition of eIF5A hypusination enhances antioxidant defense to prevent kidney Ischemia/Reperfusion injury. Redox Biology. 2025 Aug 6:86:103814. https://doi.org/10.1016/j.redox.2025.103814.
- Gallerand A, Merlin J, Caillot Z, Delaby C, Bord E, Han J, Dolfi B, Castiglione A, Grenet S, Franceschini M, Jarretou G, Zair FN, Boré E, Tuffin F, Dombrowicz D, Guinamard RR, Randolph GJ, Bertola A, Auberger P, Jacquel A, Hume DA, Williams JW, Bajénoff M, Neels JG, Ivanov S. CSF1R regulates monocyte subset differentiation and intracellular metabolism. bioRxiv [Preprint]. 2025 Jul 21:2025.07.17.665275. doi: 10.1101/2025.07.17.665275.
- Bourourou M, Melis N, Cougnon M, Laffet G, Duranton C, Rubera I, Maurin T, Heurteaux C, Hauet T, Duca M, Pisani DF, Blondeau N and Tauc M. Targeting seryl-tRNA synthetase to unlock ischemic resilience in stroke – Insights from a proof-of-concept study. Journal of Cerebral Blood Flow & Metabolism. 2025 Jun 19:271678X251347810. doi:10.1177/0271678X251347810
- Labbé V, Desnos C, Preau S, Doyen D, et al. Risk, rate or rhythm control for new onset supraventricular arrhythmia during septic shock: protocol for the CAFS multicentre, parallel-group, open-label trial. BMJ Open. 2025 Apr 1;15(4):e090404. doi: 10.1136/bmjopen-2024-090404.
- Lupatelli CA, Seassau A, Magliano M, Kuhn ML, Rey A, Poët M, Counillon L, Evangelisti E, Thomen P, Attard A, Noblin X & Galiana E. Membrane proteome analysis identifies key components of sensing in Phytophthora parasitica zoospores. Sci Rep 15, 23500 (2025). https://doi.org/10.1038/s41598-025-08701-z
- Pisani DF, Blondeau N. Deciphering the brain glucose metabolism: A gateway to innovative stroke therapies. Journal of Cerebral Blood Flow & Metabolism. 2025 May 29:271678X251346277. doi:10.1177/0271678X251346277
- Dei C, Belcadi C, Dellamonica J, Doyen D. Hemophagocytic lymphohistiocytosis complicating severe malaria: look for hemozoin. Intensive Care Med. 2025 Jan;51(1):177-178. doi: 10.1007/s00134-024-07716-w.
- Tran QD, Bouret Y, Noblin X, Jarretou G, Counillon L, Poët M* and Cohen C*. Rapid microfluidic perfusion system enables controlling dynamics of intracellular pH regulated by Na+/H+ exchanger NHE1. Lab On a Chip (2025). doi: 10.1039/D4LC00884G.
- 2024
-
- Iltis, C, et al. A ganglioside-based immune checkpoint enables senescent cells to evade immunosurveillance during aging. Nat Aging (2024). doi: 10.1038/s43587-024-00776-z
- Gallerand A, et al. Glucose metabolism controls monocyte homeostasis and migration but has no impact on atherosclerosis development in mice. Nat Commun 15, 9027 (2024). doi: 10.1038/s41467-024-53267-5.
- Pisani DF, Lettieri-Barbato D and Ivanov S. Polyamine metabolism in macrophage–adipose tissue function and homeostasis. Trends in Endocrinology and Metabolism. 2024 June. doi: 10.1016/j.tem.2024.05.008.
- Duret LC, et al. Targeting WIP1 phosphatase promotes partial remission in experimental collapsing glomerulopathy. Kidney Int. 2024 May;105(5):980-996. doi: 10.1016/j.kint.2024.02.009.
- Koch TJ, et al. Differences in birch tar composition are explained by adhesive function in the central European Iron Age. Plos ONE. 2024 PLoS One. 2024 Apr 3;19(4):e0301103. doi: 10.1371/journal.pone.0301103.
- 2023
-
- Poet M, et al. Biological fractionation of lithium isotopes by cellular Na+/H+ exchangers unravels fundamental transport mechanisms. iScience. 2023 May 15;26(6):106887. doi: 10.1016/j.isci.2023.106887.
- Melis N, et al. Renal Ischemia Tolerance Mediated by eIF5A Hypusination Inhibition Is Regulated by a Specific Modulation of the Endoplasmic Reticulum Stress. Cells. 2023; 12(3):409. doi:10.3390/cells12030409.
- 2022
-
- Hauet T, Pisani DF. New Strategies Protecting from Ischemia/Reperfusion. Int J Mol Sci. 2022 Dec 14;23(24):15867. doi: 10.3390/ijms232415867.
- Poet M, et al. How Does Our Knowledge on the Na+/H+ Exchanger NHE1 Obtained by Biochemical and Molecular Analyses Keep up With Its Recent Structure Determination? Front Physiol. 2022 Jul 15;13:907587. doi: 10.3389/fphys.2022.907587.
- Montandon M, et al. Telomerase is required for glomerular renewal in kidneys of adult mice. NPJ Regen Med. 2022 Feb 11;7(1):15. doi: 10.1038/s41536-022-00212-z.
- Doyen D, et al. Intracellular pH Control by Membrane Transport in Mammalian Cells. Insights Into the Selective Advantages of Functional Redundancy. Front Mol Biosci. 2022 Feb 18;9:825028. doi: 10.3389/fmolb.2022.825028.
- 2021
-
- Tauc M, et al. The eukaryotic initiation factor 5A (eIF5A1), the molecule, mechanisms and recent insights into the pathophysiological roles. Cell Biosci. 2021 Dec 24;11(1):219. doi: 10.1186/s13578-021-00733-y.
- Melis N, et al. Akt Inhibition as Preconditioning Treatment to Protect Kidney Cells Against Anoxia. Int J Mol Sci. 2021 Dec; 23(1):152. doi: org/10.3390/ijms2301015.
- Schwing A, et al. Identification of adipocytes as target cells for Leishmania infantum parasites. Sci Rep. 2021 Oct 28;11(1):21275. doi: 10.1038/s41598-021-00443-y.
- Napolitano T, et al. Gfi1 Loss Protects against Two Models of Induced Diabetes. Cells. 2021 Oct 10, 2805. doi: 10.3390/cells10112805.
- Munro P, et al. Impact of thermogenesis induced by chronic β3-adrenergic receptor agonist treatment on inflammatory and infectious response during bacteremia in mice. PLoS One. 2021 Aug 26;16(8):e0256768. doi: 10.1371/journal.pone.0256768.
- Carcy R, et al. Targeting oxidative stress, a crucial challenge in renal transplantation outcome. Free Radical Biology and Medicine. 2021 April. doi: 10.1016/j.freeradbiomed.2021.04.023.
- Cougnon M, et al. Inhibition of eIF5A hypusination reprogrammes metabolism and glucose handling in mouse kidney. Cell Death Dis. 2021 Mar 7;12(4):283. doi: 10.1038/s41419-021-03577-z.
- Coli VL, et al. Micro-computed tomography for discriminating between different forming techniques in ancient pottery: new segmentation method and pore distribution recognition. Archaeometry. 2021 May. doi: 10.1111/arcm.12693.
- Efthymiou G, et al. Fibronectin Extra Domains tune cellular responses and confer topographically distinct features to fibril networks. J Cell Sci. 2021 Feb 24;134(4):jcs252957. doi: 10.1242/jcs.252957.
- Raad G, et al. Paternal multigenerational exposure to an obesogenic diet drives epigenetic predisposition to metabolic diseases in mice. Elife. 2021 Mar 30;10:e61736. doi: 10.7554/eLife.61736.
- Li XC, et al. Proximal Tubule-Specific Deletion of Angiotensin II Type 1a Receptors in the Kidney Attenuates Circulating and Intratubular Angiotensin II-Induced Hypertension in PT-Agtr1a-/- Mice. Hypertension. 2021 Apr;77(4):1285-1298. doi: 10.1161/HYPERTENSIONAHA.120.16336.
- Lee HJ, et al. Proximal tubular epithelial insulin receptor mediates high-fat diet-induced kidney injury. JCI Insight. 2021 Feb 8;6(3):e143619. doi: 10.1172/jci.insight.143619.
- 2020
-
- Munro P, et al. Modulation of the inflammatory response to LPS by the recruitment and activation of brown and brite adipocytes in mice. Am J Physiol Endocrinol Metab. 2020 Nov 1;319(5):E912-E922. doi: 10.1152/ajpendo.00279.2020.
- Bourourou M, et al. Inhibition of eIF5A hypusination pathway as a new pharmacological target for stroke therapy. J Cereb Blood Flow Metab. 2020 Jul 2:271678X20928882. doi: 10.1177/0271678X20928882.
- Roux CH, et al. Oxytocin Controls Chondrogenesis and Correlates with Osteoarthritis. Int J Mol Sci. 2020 May 31;21(11):3966. doi: 10.3390/ijms21113966.
- Giraud S, et al. The inhibition of eIF5A hypusination by GC7, a preconditioning protocol to prevent brain death-induced renal injuries in a preclinical porcine kidney transplantation model. Am J Transplant. 2020 Dec;20(12):3326-3340. doi: 10.1111/ajt.15994.
- Rolver MG, et al. Pyrazine ring-based Na+/H+ exchanger (NHE) inhibitors potently inhibit cancer cell growth in 3D culture, independent of NHE1. Sci Rep. 2020 Apr 2;10(1):5800. doi: 10.1038/s41598-020-62430-z.
- Tauc M. Un nouveau paradigme dans le traitement de l’ischémie - L’apport de la drosophile [A new paradigm in the treatment of ischemia. Learning from drosophila]. Med Sci (Paris). 2020 Feb;36(2):147-152. French. doi: 10.1051/medsci/2020012. Epub 2020 Mar 4. PMID: 32129751.
- Nicolas S, et al. The adiponectin receptor agonist AdipoRon normalizes glucose metabolism and prevents obesity but not growth retardation induced by glucocorticoids in young mice. Metabolism. 2020 Feb;103:154027. doi: 10.1016/j.metabol.2019.154027.
- Dumortier O, et al. microRNA-375 regulates glucose metabolism-related signaling for insulin secretion. J Endocrinol. 2020 Jan 1;244(1):189-200. doi: 10.1530/JOE-19-0180.
- Thallas-Bonke V, et al. Targeted deletion of NADPH-Oxidase Nox4 from proximal tubules is dispensable for diabetic kidney disease development. Nephrol Dial Transplant. 2020 Dec 24:gfaa376. doi: 10.1093/ndt/gfaa376.
- 2019
-
- Friard J, et al. LRRC8/VRAC channels exhibit a noncanonical permeability to glutathione, which modulates epithelial-to-mesenchymal transition (EMT). Cell Death Dis. 2019 Dec 5;10(12):925. doi: 10.1038/s41419-019-2167-z.
- Leboucher A, et al. Fmr1-Deficiency Impacts Body Composition, Skeleton, and Bone Microstructure in a Mouse Model of Fragile X Syndrome. Front Endocrinol (Lausanne). 2019 Oct 2;10:678. doi: 10.3389/fendo.2019.00678.
- Pedersen SF, Counillon L. The SLC9A-C Mammalian Na+/H+ Exchanger Family: Molecules, Mechanisms, and Physiology. Physiol Rev. 2019 Oct 1;99(4):2015-2113. doi: 10.1152/physrev.00028.2018.
- Li XC, et al. Proximal Tubule-Specific Deletion of the NHE3 (Na+/H+ Exchanger 3) in the Kidney Attenuates Ang II (Angiotensin II)-Induced Hypertension in Mice. Hypertension. 2019 Sep;74(3):526-535. doi: 10.1161/HYPERTENSIONAHA.119.13094.
- Fabris G, et al. Amino acid-induced regulation of hepatocyte growth: possible role of Drosha. Cell Death Dis. 2019 Jul 22;10(8):566. doi: 10.1038/s41419-019-1779-7.
- Roger E, et al. Argonaute-2 is associated to brown adipose tissue activation. Biochim Biophys Acta Mol Basis Dis. 2019 Sep 1;1865(9):2393-2402. doi: 10.1016/j.bbadis.2019.05.018. Epub 2019 May 30.
- Melis N, et al. Emerging therapeutic strategies for transplantation-induced acute kidney injury: protecting the organelles and the vascular bed. Expert Opin Ther Targets. 2019 Jun;23(6):495-509. doi: 10.1080/14728222.2019.1609451.
- Colson C, et al. Diet Supplementation in ω3 Polyunsaturated Fatty Acid Favors an Anti-Inflammatory Basal Environment in Mouse Adipose Tissue. Nutrients. 2019 Feb 20;11(2):438. doi: 10.3390/nu11020438.
- Leboucher A, et al. The translational regulator FMRP controls lipid and glucose metabolism in mice and humans. Mol Metab. 2019 Mar;21:22-35. doi:10.1016/j.molmet.2019.01.002.
- 2018
-
- Li XC, et al. Proximal Tubule-Specific Deletion of the NHE3 (Na+/H+ Exchanger 3) Promotes the Pressure-Natriuresis Response and Lowers Blood Pressure in Mice. Hypertension. 2018 Dec;72(6):1328-1336. doi: 10.1161/HYPERTENSIONAHA.118.10884.
- Babaei R,et al. Jak-TGFβ cross-talk links transient adipose tissue inflammation to beige adipogenesis. Sci Signal. 2018 Apr 24;11(527):eaai7838. doi: 10.1126/scisignal.aai7838. PMID: 29692363.
- Sagiv A, et al. p53 in Bronchial Club Cells Facilitates Chronic Lung Inflammation by Promoting Senescence. Cell Rep. 2018 Mar 27;22(13):3468-3479. doi: 10.1016/j.celrep.2018.03.009. PMID: 29590616.
- Barquissau V, et al. Caloric Restriction and Diet-Induced Weight Loss Do Not Induce Browning of Human Subcutaneous White Adipose Tissue in Women and Men with Obesity. Cell Rep. 2018 Jan 23;22(4):1079-1089. doi: 10.1016/j.celrep.2017.12.102.
- Ghandour RA, et al. Impact of dietary ω3 polyunsaturated fatty acid supplementation on brown and brite adipocyte function. J Lipid Res. 2018 Mar;59(3):452-461. doi: 10.1194/jlr.M081091.
- Pisani DF, et al. Mitochondrial fission is associated with UCP1 activity in human brite/beige adipocytes. Mol Metab. 2018 Jan;7:35-44. doi: 10.1016/j.molmet.2017.11.007.
- 2017
-
- Melis N, et al. Targeting eIF5A Hypusination Prevents Anoxic Cell Death through Mitochondrial Silencing and Improves Kidney Transplant Outcome. J Am Soc Nephrol. 2017 Mar;28(3):811-822. doi: 10.1681/ASN.2016010012.
- Friard J, et al. Comparative Effects of Chloride Channel Inhibitors on LRRC8/VRAC-Mediated Chloride Conductance. Front Pharmacol. 2017 May 31;8:328. doi: 10.3389/fphar.2017.00328.PMID: 28620305; PMCID: PMC5449500.
- Cophignon A, et al. CD95-Mediated Proton Regulation. Methods Mol Biol. 2017 ;1557:95-102. doi: 10.1007/978-1-4939-6780-3_9. PMID: 28078585.
- Barquissau V, et al. Control of adipogenesis by oxylipins, GPCRs and PPARs. Biochimie. 2017 May;136:3-11. doi: 10.1016/j.biochi.2016.12.012.
- Dumortier O, et al. Age-Dependent Control of Energy Homeostasis by Brown Adipose Tissue in Progeny Subjected to Maternal Diet-Induced Fetal Programming. Diabetes. 2017 Mar;66(3):627-639. doi: 10.2337/db16-0956.